Sclerotinia sclerotiorum
SCLEROTINIA SCLEROTIORUM
(Libert) de Bary
Systematyka
Gromada: Ascomycota
Podgromada: Pezizomycotina
Klasa: Leotiomycetes
Rząd: Helotiales
Rodzina: Sclerotiniaceae
Rodzaj: Sclerotinia
Gatunek: Sclerotinia sclerotiorum (Libert) de Bary
Synonimy:
Peziza sclerotiorum Lib.
Sclerotinia libertiana Fuckel
Hymenoscyphus sclerotiorum (Lib.) W. Phillips
Sclerotium varium Pers.
Whetzelinia sclerotiorum (Lib.) Korf & Dumont
Grzyba tego opisano już w 1837 roku, a pierwszą jego nazwą była Peziza sclerotiorum Lib. (Libert 1837). Obecna nazwa Sclerotinia sclerotiorum została użyta pierwszy raz w 1884 roku przez de Bary (Bolton i in. 2006). Gatunek znajduje się wśród patogenów roślin o największym znaczeniu ekonomicznym, a jednocześnie jest jednym z najbardziej powszechnych na świecie. Polifag ten do lat 80. XX wieku zidentyfikowany został na 383 gatunkach (Purdy 1979), a w 2008 podawano już, że poraża ponad 500 gatunków (Saharan i Mehta 2008). O dużym znaczeniu świadczy fakt, że w odniesieniu do chorób wywoływanych przez S. sclerotiorum użyto ponad 60 nazw (Purdy 1979). W Polsce najczęściej spotykanymi nazwami jest zgnilizna twardzikowa, biała pleśń oraz zgorzel łodygi (Starzycki i Starzycka 1999). Gospodarzami S. sclerotiorum są głównie rośliny dwuliścienne, rzadko jednoliścienne (trawy, zboża, choć poraża np. cebulę, tulipany). W Polsce jego występowanie stwierdzono na rzepaku, tytoniu, marchwi, pietruszce, buraku, ogórku, pomidorze, fasoli, soi, słoneczniku oraz na innych roślinach warzywnych (Kryczyński 2002). Wysokie szkody (nawet do 30%) powoduje w uprawach rzepaku ozimego, jak i trochę w mniejszym stopniu rzepaku jarego i tytoniu (Starzycki i Starzycka 1999, Gwiazdowski i Korbas 2006). W USA w latach o korzystnych warunkach klimatycznych dla rozwoju patogena straty finansowe spowodowane wystąpieniem S. sclerotiorum szacowane były na 200 milionów dolarów (Bolton i in. 2006). Wszystkie rośliny dyniowate są podatne na zgniliznę twardzikową. Przykładowo w USA często występuje w uprawie polowej dyni oraz na ogórku szklarniowym (Keinath i in. 2017). Biała pleśń dyniowatych jest wywoływana głównie przez S. sclerotiorum, ale czasem w polowej uprawie ogórka może wystąpić Sclerotinia minor. Na przykład w Kanadzie S. sclerotiorum jest powszechna w całym kraju, natomiast S. minor występuje przede wszystkim w południowo-zachodnim Ontario, głównie jako patogen sałaty (Howard i in. 1994).
Jak już wspomniano opisywany patogen występuje powszechnie i ma bardzo szeroki zasięg geograficzny i klimatyczny (Domsch i in. 1993). Lubi zwłaszcza tereny chłodne i wilgotne, ale występuje na wszystkich kontynentach. Kiedy temperatura spada poniżej 0°C lub osiąga ponad 32°C, jego patogeniczność słabnie (Purdy 1979, Willetts i Wong 1980).
Symptomy
Grzyb poraża rośliny we wszystkich fazach wzrostu. Objawy infekcji są bardzo specyficzne i łatwe do rozpoznania (Fig. 5-13). Na rzepaku zgnilizna twardzikowa występuje najczęściej na łodydze (szczególnie w niższych partiach, blisko gleby; Fig. 5). Pojawiają się na niej jasnobrązowe, bądź jasnoszare owalne plamy, które z czasem ciemnieją. Obejmują one całość lub tylko część obwodu łodygi. Plamy często pokrywa warstwa białej grzybni, która stopniowo przerasta tkanki i dostaje się do wnętrza łodygi, gdzie tworzą się początkowo białe do kremowych, a następnie ciemniejące i ostatecznie czarne skupienia strzępek – skleroty (Fig. 4). Czasem czarne przetrwalniki są widoczne nawet na powierzchni łodygi, a także w łuszczynach (Kryczyński 2002). Silnie porażony rzepak staje się łamliwy, pęka i przedwcześnie zamiera. Objawy mogą być również widoczne na liściach, choć są trudne do rozpoznania. Zainfekowane liście brunatnieją, zamierają i gniją.
U roślin dyniowatych patogena najczęściej można zauważyć na porażonych łodygach i owocach roślin dyniowatych. Może infekować łodygi blisko gleby (Fig. 8-10), a także liście i owoce nadziemne (Fig. 11). Infekcja zwykle zaczyna się od martwej lub obumierającej tkanki. Mogą to być na przykład zwiędłe liścienie, a zwłaszcza kwiaty, które pozostają przyczepione do owoców lub przylegają do innej części rośliny po opadnięciu. Na owocach infekcja występuje głównie na końcu kwiatu (Fig. 11), gdzie objawy są często mylone z objawami szarej pleśni. Przy zgniliźnie twardzikowej grzybnia jest zawsze czysto biała, nigdy w odcieniach szarości lub brązu (Howard i in. 1994). Zdarza się, że zainfekowane owoce wysychają i mumifikują (Keinath i in. 2017).
Objawy choroby na ogórku uwidaczniają się na łodygach, liściach, kwiatach i owocach. Infekcja rozpoczyna się mokrymi plamami, po których następuje wzrost białej grzybni pokrytej kroplami wody podobnymi do rosy na zainfekowanych owocach. Zaatakowane owoce ogórka stają się wodniste, miękkie, a później rozwijają się na nich sklerocja. Owoce gniją całkowicie w 3-5 dni. Podobne objawy występują na łodydze, liściach i ogonkach liściowych (Fig. 8-10). Obserwuje się zmiany chorobowe na łodydze pokrytej grubą białą grzybnią, co powodujące mokre zmiany na ogonkach liściowych, co z kolei prowadzi do chlorotycznych, nekrotycznych plam na liściach (Zakeri 1998). Zgnilizna najczęściej dotyczy starszych organów rośliny. Po pojawieniu się grzybni patogena na łodydze, organ ten wysycha i więdnie, a w gnijących tkankach pojawiają się małe, czarne sklerocja. Zakażeniu sprzyja zwłaszcza, jak już wspominano, chłodne i wilgotne środowisko, które zwykle występuje w warunkach szklarniowych. W szklarniach można obserwować wyjątkowo szybkie pokrywanie się zakażonych wodnistych i miękkich tkanek białą puszystą grzybnią patogena (Abdel-Kader i in. 2012). Choroba nasila się tutaj w wyniku złego zarządzania uprawą. Nie jest powszechna w szklarniach i nie powinna w nich występować, jeśli rośliny są chronione przed kroplami wody i omgławianiem, zwłaszcza podczas kwitnienia (Howard i in. 1994).
Morfologia
Na pożywce PDA (potato dextrose agar) kolonie S. sclerotiorum rosną bardzo szybko i po 4 dniach inkubacji w temperaturze 24ºC osiągają 4-8 cm średnicy, a po 8 dniach zarastają całą płytkę Petriego. Najlepsza temperatura do wzrostu to 15-25°C, a pH podłoża 4-5,5. Grzybnia jest puszysta i biała/hialinowa, ale zdarzają się też izolaty szarawe i kremowe. Plecha składa się z rozgałęziających się wielojądrowych strzępek (Bolton i in. 2006). Po dłuższej hodowli (2-3 tygodnie) głównie na obrzeżach płytki tworzą się sklerocja – ciemne przetrwalniki (Fig. 1 i 2). Są one najczęściej owalne/kuliste, ale występują też podłużne z ostrymi końcami. Ich średnica wynosi 2-12 mm (Adams i Ayers 1979), a rozmiary różnią się bardzo w zależności od rośliny-gospodarza (Fig. 4). Sklerotium to skupisko strzępek, które zawdzięcza czarną barwę znajdującej się w warstwie zewnętrznej melaninie. Uważa się, że składnik ten odgrywa istotną rolę w ochronie przed niekorzystnymi warunkami środowiska, rozkładem przez mikroorganizmy (Bell i Wheeler 1986, Henson i in. 1999), a u niektórych grzybów także w wirulencji (Thomma 2003). W przypadku S. sclerotiorum zależności pomiędzy patogenicznością a melaniną nie stwierdzono (Saharan i Mehta 2008). Warstwa wewnętrzna (medulla) jest jasna i o luźniejszej strukturze (Bolton i in. 2006). Jest osadzona we włóknistej macierzy i składa się z węglowodanów, głównie β-glukanów i białek (LeTourneau 1979). Wyróżniono 3 fazy rozwoju sklerocjum. Pierwsza z nich to inicjacja, czyli agregacja grzybni i utworzenie białej masy zwanej zaczątkami sklerocyjnymi (sclerotial initials). Druga faza wzrostu polega na wzroście grzybni i dalszej agregacji, a co za tym idzie zwiększeniu rozmiaru. Ostatnia faza dojrzewania polega na rozgraniczeniu warstwy zewnętrznej, odkładaniu melaniny w komórkach peryferyjnych i wzmocnieniu wewnętrznym (Townsend i Willetts 1954). W warunkach laboratoryjnych na rozwój sklerocjów znacząco wpływa pH pożywki – przy odczynie obojętnym lub zasadowym znacznie spada zdolność do ich wytwarzania (Rollins i Dickman 2001). Neutralne lub zasadowe pH powoduje ponadto większą kumulację kwasu szczawiowego – silnej mykotoksyny wytwarzanej przez S. sclerotiorum. Na podstawie zdolności do jej wytwarzania, szybkości przerastania i opanowywania rośliny-gospodarza, zdolności do tworzenia apotecjów oraz polimorfizmu DNA wyróżniono patotypy (Starzycka i in. 2004). Stwierdzono duże różnice w patogeniczności różnych izolatów. Kultury, które wytwarzają więcej kwasu szczawiowego, tworzą mniej sklerocjów, ale są za to bardziej agresywne (Harel i in. 2005). Mało patogeniczne izolaty nie mają zdolności tworzenia kwasu szczawiowego (Starzycki i Starzycka 1999, Starzycka i in. 2000). Nie stwierdzono zależności pomiędzy patogenicznością, a zabarwieniem kolonii, o czym już wspomniano, i tempem wzrostu kolonii S. sclerotiorum (Garg i in. 2010). Wśród czynników wpływających na formowanie sklerocjów oprócz pH wymienia się m.in. temperaturę, światło, dostępność składników odżywczych oraz potencjał osmotyczny podłoża (Saharan i Mehta 2008). Szacuje się, że nawet 90 % cyklu życiowego Sclerotinia sclerotiorum może spędzić w postaci sklerot w glebie. Ich przeżywalność zależy od wielu czynników, m.in. składu biologicznego gleby, a w szczególności obecności grzybów nadpasożytniczych (Adams i Ayers 1979).
S. sclerotiorum nie zimuje w postaci grzybni (Kochman 1973). Zdolność tą posiadają skleroty, które mogą przeżyć w glebie do 8 lat (Adams i Ayers 1979, Bolton i in. 2006). Są one pierwotnym źródłem zakażenia roślin (Purdy 1979). Niektóre z nich opadają na ziemię z łodyg, ale większość dostaje się do gleby z pozostawionych resztek roślinnych. Ilość inokulum w postaci sklerot może być zwiększana poprzez produkcję wtórnych sklerot w glebie albo ich wytwarzanie na roślinach (Williams i Western 1965).
Ze względu na ogromny potencjał reprodukcyjny oraz możliwość długoterminowego przeżycia, sklerocja są najważniejszym składnikiem cyklu chorobowego. Mogą one kiełkować karpogenicznie lub myceliogenicznie, w zależności od warunków środowiska, co wiąże się też dwoma odrębnymi rozwojami choroby. Sklerocja, która kiełkują myceliogenicznie, wytwarzają strzępki zdolne bezpośrednio atakować tkanki gospodarza (Bardin i Huang 2001, LeTourneau 1979). Sklerocja, która kiełkują karpogenicznie, produkują apotecja, a następnie askospory, które infekują nadziemne części roślin żywicielskich. Chociaż opisywany gatunek uważany jest za patogena przenoszonego w glebie („soilborne”), infekcja następuje w większości przypadków poprzez „airborne” askospory (Keinath i in. 2017). Kiełkowanie sklerocjów obserwuje się w temperaturze 20-25˚C, przy początkowym pH podłoża 5 i powyżej 80% wilgotności względnej (Huang i in. 1998). Na sklerocjach tworzą się żółto-brązowe lub jasnobrunatne miseczkowate owocniki, wypełnione workami z zarodnikami workowymi. Tylko dojrzałe sklerocjum jest zdolne do wytworzenia zazwyczaj jednego apotecjum (Saharan i Mehta 2008). Zbadano, że owocniki najczęściej powstają na średniej wielkości sklerocjach i wymagany jest do tego roczny okres spoczynku. Zdarza się jednak, że mogą pojawić się jeszcze w tym samym roku (Kochman 1973). W warunkach laboratoryjnych obserwowane są bardzo rzadko. Średnica apotecjum wynosi 3-8 mm. Osadzone jest na około 2-3 cm nitkowatej nóżce o średnicy 1-2 mm (Domsch i in. 1993). Długość nóżek zależy od tego, jak głęboko sklerocjum znajduje się w glebie – jeśli są głębiej niż 8 cm, to nie wytwarzają owocników. Worki buławkowatego kształtu są długości 110-125 μm i szerokości 6-10 μm (Kochman 1973). Wytwarzane przez nich zarodniki workowe są podłużne, jednokomórkowe, bezbarwne, dwujądrowe i zazwyczaj o wymiarach 4-6 μm x 9-14 μm. Optymalna temperatura wynosi 20-25°C, choć mogą być wytwarzane nawet w 5°C. Wysoka wilgotność powietrza sprzyja zarodnikowaniu (Abawi i Grogan 1979, Domsch i in. 1993). Askospory przeżywają najdłużej, gdy są suche. Czas przetrwania zależy zarówno od temperatury, jak i wilgotności. Wiadomo, że w glebie mogą przetrwać 12 dni (Grogan i Abawi 1975).
S. sclerotiorum nie posiada stadium konidialnego, jednak na strzępkach lub pomiędzy workami na osobnych krótkich strzępkach grzybni tworzą się w łańcuszkach mikrokonidia (Kochman 1973). Mają wielkość 2,5-3,2 μm i powstają na płasko zakończonych fialidach (Fig. 3). Na pożywkach sztucznych obserwuje się je bardzo rzadko, zazwyczaj po bardzo długim okresie inkubacji, gdy wyczerpane zostaną składniki odżywcze z podłoża (Domsch i in. 1993). Mikrozarodniki nie mają większego znaczenia – nie biorą udziału ani w infekcji, ani w rozprzestrzenianiu się choroby, nie kiełkują i ich rola w biologii grzyba jest nadal nieznana (Bolton i in. 2006).
Wiele badań wykazało, że kilka antagonistycznych mikroorganizmów (grzyby, bakterie, promieniowce, drożdże, algi i grzyby) ma zdolność obniżania patogenicznej aktywności S. sclerotiorum (Saharan i Mehta 2008). Grzyby rodzajów Aspergillus, Coniothyrium (C. minitans), Gliocladium, Penicillium, Stachybotrys i Trichoderma są znane z dużej skuteczności w niszczeniu strzępek oraz sklerot patogena (Adams i Ayers 1979). Supresja patogena przez antagonistów odbywa się różnymi drogami – m.in. poprzez pasożytnictwo, drapieżnictwo, konkurencję o składniki odżywcze i przestrzeń życiową, mechaniczne zahamowanie oraz produkcję toksycznych i hamujących metabolitów (Saharan i Mehta 2008).
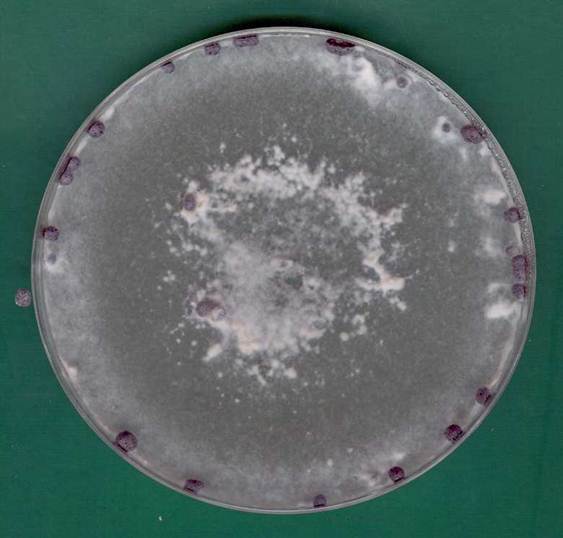
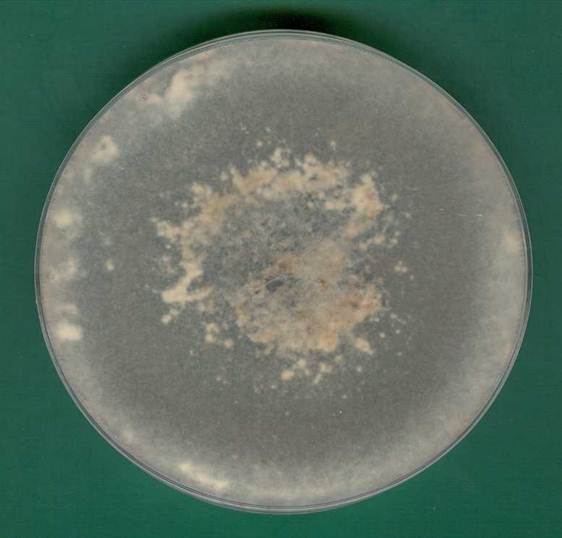
Fig. 1. Czternastodniowa kultura Sclerotinia sclerotiorum na pożywce PDA
Fig. 2. Spód czternastodniowej kultury Sclerotinia sclerotiorum na pożywce PDA
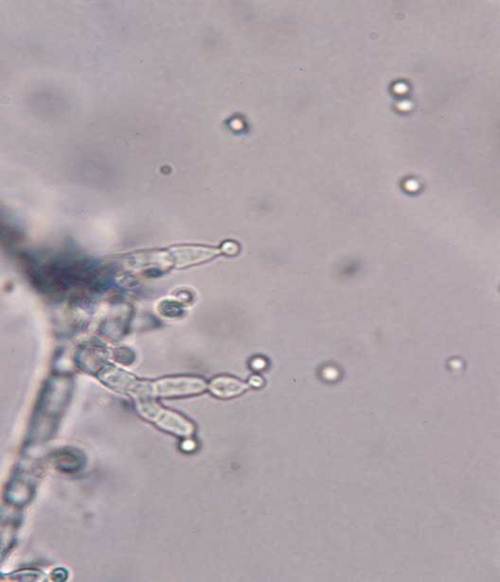

Fig. 3. Mikrokonidia S. sclerotiorum
Fig. 4. Sklerocja S. sclerotiorum


Fig. 5. Objawy porażenia łodygi rzepaku przez S. sclerotiorum
Fot. 6. Sklerocja S. sclerotiorum w łodydach słonecznika


Fig. 7. Objawy porażenia łodygi słonecznika przez S. sclerotiorum
Fig. 8. Objawy porażenia łodygi ogórka przez S. sclerotiorum


Fig. 9. Biała grzybnia S. sclerotiorum na porażonych roślinach ogórka
Fig. 10. Biała zgnilizna ogórka

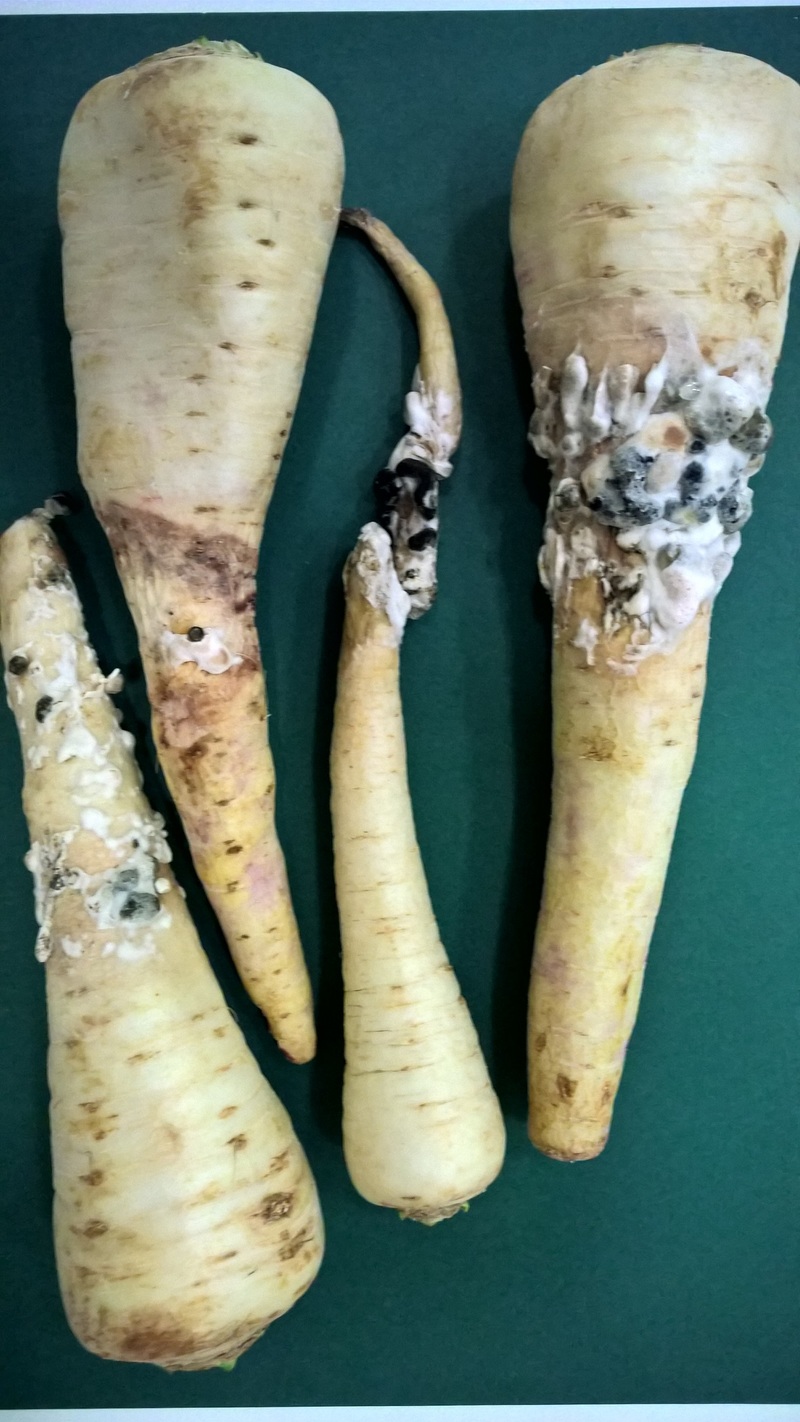
Fig. 11. Owoce cukinii porażonej przez S. sclerotiorum
Fig. 12. Korzeń pietruszki z objawami zgnilizny twardzikowej

Fig. 13. Roślina łubinu porażona przez S. sclerotiorum