Fusarium oxysporum
FUSARIUM OXYSPORUM
Schlecht. emend. Snyder & Hansen
Systematyka
Stadium teleomorfy
Gromada: Ascomycota
Podgromada: Ascomycotina
Klasa: Sordariomycetes
Rząd: Hypocreales
Rodzina: Nectriaceae
Stadium anamorfy
Grzyby mitosporowe (anamorficzne) – Fungi Imperfecti
Grupa morfologiczna: Hypomycetes
Rodzaj: Fusarium
Gatunek: Fusarium oxysporum Schltdl.
Fusarium oxysporum należy do najczęściej spotykanych gatunków rodzaju. Występuje we wszystkich strefach klimatycznych, głównie w glebie (Booth 1971). Zazwyczaj występuje w glebach uprawnych, rzadziej w leśnych (Domsch i in. 1980). Preferuje ciepło, wysoką wilgotność, obojętny lub lekko kwaśny odczyn gleby (Taylor 1964). Okresy chłodu przeżywa głównie w postaci chlamydospor (zarodników przetrwalnikowych) oraz grzybni w glebie i na resztkach roślinnych. Bywa głównie saprotrofem, a także endofitem kolonizującym korzenie roślin. Wiele jego szczepów ma właściwości chorobotwórcze, porażając bardzo liczne rośliny nago- i okrytozalążkowe, głównie jednak rośliny dwuliścienne. W mniej typowych warunkach pogodowych poraża rośliny zbożowe. Ze względu na powodowane straty ekonomiczne jest uznawany za najgroźniejszego patogena rodzaju.
W Polsce bardzo duże znaczenie ma więdnięcie łubinu żółtego (do 80% porażenia), grochu i innych roślin bobowatych, powodowane przez F. oxysporum (Fig. 5-8). W skali światowej największe straty ponoszą len i banany w Ameryce Centralnej (Alexopoulos 1962, Borecki 1996).
Od ponad kilkudziesięciu lat F. oxysporum jest określany gatunkiem zbiorowym obejmującym obecnie ponad 150 form specjalnych (formae speciales) i ras. Formy specjalne zaczęli różnicować Armstrong i Armstrong (1948) – pod koniec zawodowego życia rozpoznali ich ok. 80 (Armstrong i Armstrong 1981). Aktualnie jest ich ok 150, a liczba ta będzie nadal rosła. Generalnie forma specjalna poraża jeden gatunek rośliny. Jednak takich form jest w rzeczywistości niewiele: ff. betae, cyclaminis, fragariae, glycines, lycopersici, medicaginis, passiflorae, perniciosum, ricini, sezami, voandzeae. Większość form cechuje ograniczona specjalizacja, porażają bowiem więcej (od kilku do kilkudziesięciu) gatunków roślin – gospodarzy drugorzędowych, na ogół w stopniu mniejszym niż roślinę –gospodarza pierwszorzędowego (Armstrong i Armstrong 1975).
W okresie braku rośliny-gospodarza patogeny mogą bytować bezobjawowo w tzw. roślinach-rezerwuarach, będących niepodatnymi gospodarzami (Armstrong i Armstrong 1948). Te wyjątkowe zdolności adaptacyjne sprawiają, że F. oxysporum może bytować w glebie prawdopodobnie nieograniczenie. Zmienność gatunku związana z adaptacją do bardzo różnorodnych gatunków, dotyczy nie tylko cech fizjologicznych i sposobu życia, ale także cech morfologicznych (Domsch i in. 1980).
Symptomy
Fusarium oxysporum jest sprawca kompleksu chorób określanych zgorzelami lub fuzariozami. Występują one w całym cyklu rozwojowym roślin. Poczynając od zgorzeli przedwschodowej i powschodowej siewek, przez zgniliznę korzeni, zgorzel podstawy łodyg, plamistość liści po zgorzel naczyniową (więdnięcie fuzaryjne – wilt disease) oraz fuzariozę nasion (Fig. 5-10). Badacze amerykańscy dzielą fuzariozy na choroby kory i walca osiowego. Te pierwsze – niespecyficzne powodowane są przez F. oxysporum oraz inne gatunki rodzaju, natomiast więdnięcie naczyniowe przez F. oxysporum. Znane są ponadto suche zgnilizny różnorodnych organów roślin, m.in. cebul tulipanów i bulw ziemniaków.
W czasie wschodów roślin grzyb bytujący w zakażonych nasionach lub w glebie uniemożliwia kiełkowanie, powodując także masowe wypadanie zupełnie nieodpornych siewek skiełkowanych. Patogen wnika przez rany w miejscu tworzenia się korzeni bocznych, przez otwory w naczyniach (pits) oraz w okolicy szyjki korzeniowej. Korzenie brązowieją, a potem gniją. Widoczne są ciemne obwódki wokół szyjki korzeniowej.
Więdnięcie fuzaryjne występuje najsilniej w fazie kwitnienia, gdy odporność roślin ulega obniżeniu. Każda forma specjalna ma zdolność do pokonania endodermy i dotarcia do naczyń rośliny-gospodarza. Po kilku dniach grzybnia w naczyniach wytwarza zarodniki (mikrokonidia), które bardzo szybko docierają do wierzchołka rośliny, płynąc wraz ze strumieniem wody wewnątrz naczyń. Zwykle wokół naczynia uwidacznia się zbrunatnienie, widoczne na przekroju pędu, a także w postaci smug na łodygach. Według Armstrong i Armstrong (1975) przebarwienie naczyń nie jest cechą charakterystyczną, występuje bowiem często bez objawów zewnętrznych więdnięcia. Charakterystycznymi zewnętrznymi objawami więdnięcia jest ograniczenie wzrostu rośliny, zwisanie liści (epinastia) – postępujące na ogół od dołu do góry rośliny, żółknięcie, następnie brunatnienie i opadanie liści, zwykle najpierw dolnych, jak u pomidora. Jednak np. u bobiku schną najpierw górne liście. Pojawiają się nekrozy sektorów liści, charakterystyczne jest występowanie objawów po jednej stronie rośliny (Armstrong i Armstrong 1968). Na pędach uwidacznia się różowawy nalot zarodników. Często rośliny wyginają się pastorałowato i zasychają. Na polu widać place zamarłych roślin (Fig. 8).
Duże znaczenie w chorobie mają toksyny, wytwarzane przez F. oxysporum, wytwarzane niespecyficznie w stosunku do rośliny-gospodarza: kwas fuzariowy, mniej ważna lykomarazmina, diacetoxyscirpenol. Wpływają one na przepuszczalność błon komórkowych i inne procesy metaboliczne. Partycypują wraz z tworzącymi się tylozami i gumowatymi substancjami w czopowaniu naczyń, razem z grzybnią oraz zarodnikami i enzymami. Proces kończy się więdnięciem roślin.
Morfologia
Na podłożu PDA (potato dextrose agar) grzyb rośnie w postaci białej, kremowej, brunatnożółtej lub łososiowej kolonii z charakterystycznymi sektorami koloru fioletowego (Fig. 1). Rewers kolonii jest często ciemnofioletowy, czasami szkarłatno-brunatny (Fig. 2). Grzybnia może być zarówno luźna, jak i gęsta, kłaczkowata, watowata, zbita w miarę starzenia się. Niektóre kultury wytwarzają sporodochia – nieregularne, śluzowate, pomarańczowe lub kremowe skupiska strzępek i zarodników (Owen 1956).
Optymalna temperatura wzrostu wynosi 25–30°C. Po 24 godzinach wzrostu w temperaturze 24°C kolonie osiągają 4,5–6,5 cm średnicy (Owen 1956, Domsch i in. 1980). Zakres pH dla wzrostu grzybni wynosi 3,0–10,0, podczas gdy optymalne pH dla kiełkowania konidiów to 5,1–6,0 (Huang i in. 1988, Shim i Lee 1988).
Po kilku dniach wzrostu w warunkach laboratoryjnych zaczyna się wytwarzanie licznych bezbarwnych zarodników – mikrokonidiów (Fig. 3), tworzących tzw. fałszywe główki na krótkich, zazwyczaj nierozgałęzionych fialidach konidioforów. Zarodniki są elipsoidalne, cienkościenne, zazwyczaj proste, rzadziej zakrzywione, o wymiarach 7–14 × 2–4 μm.
Zarodniki typu makrokonidialnego nie tworzą się we wszystkich kulturach. Mają kształt wrzeciona i są w większości wyprostowane, ale bywają lekko zakrzywione. Są zakończone na ogół stopką (Fig. 4). Przegród w makrokonidiach może być od 3 do 7 (dominują 3-5-przegrodowe). Wymiary są następujące:
- z 3 przegrodami: 27–46 × 3–5 μm,
- z 5 przegrodami: 35–60 × 3–5 μm,
- z 6–7 przegrodami: 50–66 × 3,5–5 μm (Owen 1956, Domsch i in. 1980).
Konidia mogą przetrwać w temperaturze 50°C przez 24 godziny. Wzrost grzybni i kiełkowanie zarodników jest hamowane przez światło (Huang i in. 1988).
Gatunek ten tworzy liczne chlamydospory o wymiarach 5-15 mm, o gładkich lub szorstkich ściankach. Powstają obficie w 20–25°C w sterylizowanej glebie i w 15–20°C w niesterylizowanej glebie (Iida i in. 1982).
Z powodu ogromnej zmienności identyfikowanie F. oxysporum sprawia duże trudności. Problematyczne jest zwłaszcza odróżnienie tego gatunku od F. solani. Za jedyną wyraźną różnicę uważa się budowę konidiofora. Jest on krótki oraz pozbawiony przegrody u podstawy u F. oxysporum, a długi z wyraźną przegrodą u F. solani (Matuo 1972). U F. solani występują ponadto zarodniki workowe, powstające w wyniku procesu płciowego. Kolor grzybni jest u F. solani zwykle szaro-biały, czasem nawet zielonkawy, a szerokość zarodników większa (ok. 5 µm) niż u F. oxysporum.
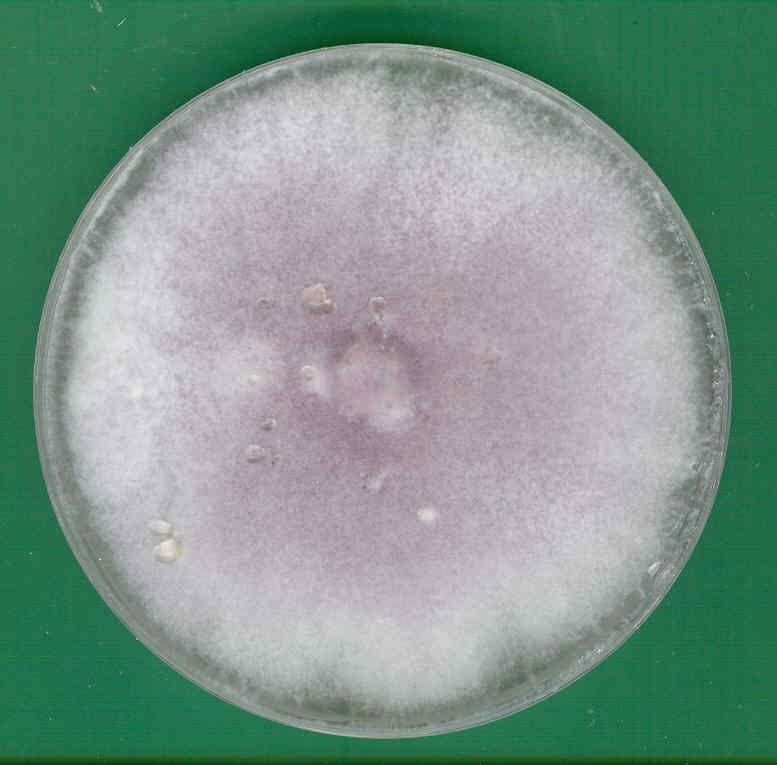

Fig. 1. Czternastodniowa kultura F. oxysporum na pożywce PDA
Fig. 2. Spód czternastodniowej kultury F. oxysporum na pożywce PDA
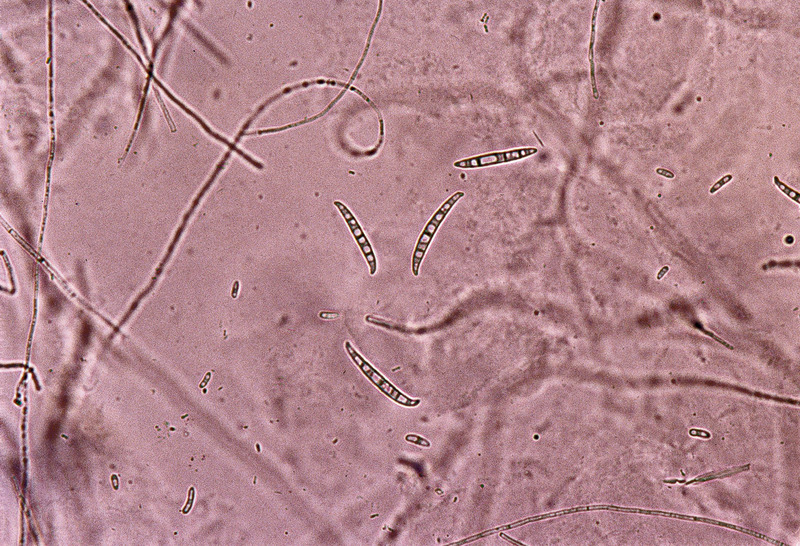
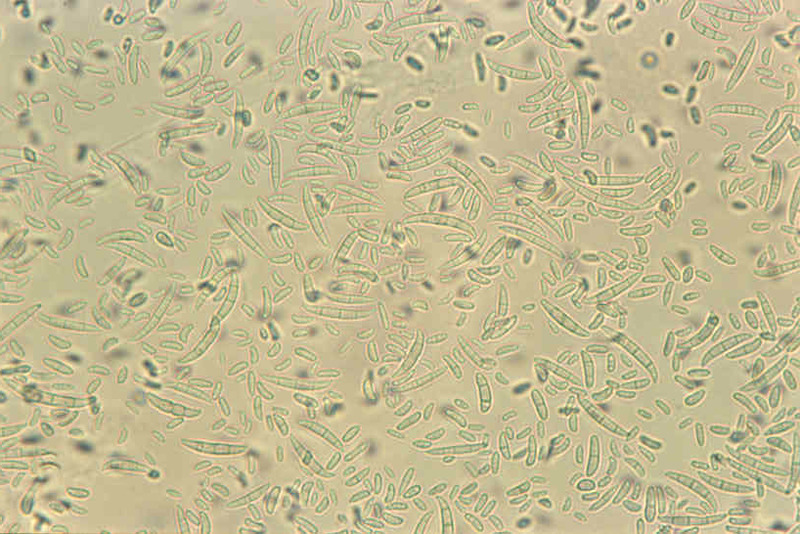
Fig. 3. Makrokonidia F. oxysporum
Fig. 4. Makro- i mikrokonidia F. oxysporum


Fig. 5. Żółknięcie porażonych F. oxysporum siewek łubinu w stadium „rozetki”
Fig. 6. Fuzaryjne więdnięcie grochu – żółknące zasychające rośliny


Fig. 7. Żółknięcie liści fasoli porażonej F. oxysporum
Fig. 8. Fuzaryjne więdnięcie łubinu – placowe zamieranie roślin


Fig. 9. Nalot grzybni F. oxysporum na łodydze kukurydzy (M. Korbas)
Fig. 10. Korzeń buraka porażony przez F. oxysporum