Pythium ultimum
Pythium ultimum
Trow
Obecna nazwa: Globisporangium ultimum
(Trow) Uzuhashi, Tojo & Kakish.
Systematyka
Stadium teleomorfy:
Królestwo: Chromista
Gromada: Oomycota
Klasa: Oomycetes
Rząd: Pythiales
Rodzina: Pythiaceae
Rodzaj: Globisporangium
Gatunek: Globisporangium ultimum (Trow) Uzuhashi, Tojo & Kakish.
Synonimy:
Globisporangium ultimum var. sporangiiferum (Drechsler) Uzuhashi, Tojo & Kakish.
Globisporangium ultimum var. ultimum (Trow) Uzuhashi, Tojo & Kakish.
Pythium ultimum var. sporangiiferum Drechsler
Pythium ultimum var. ultimum Trow
Patogen został pierwotnie wyizolowany w Anglii z siewek rzeżuchy z objawami zgnilizny. Należy do organizmów kosmopolitycznych, występujących zarówno w chłodnym, jak i umiarkowanie ciepłym klimacie. W 2001 roku zauważono jego obecność w szklarniach klimatu arktycznego na Spitsbergenie (Tojo i in. 2001). Jest jednym z najczęściej występujących w glebie gatunkiem rodzaju Pythium sensu lato (Van der Plaats-Niterink 1981). Znajdowany jest w Kalifornii, Teksasie, Kanadzie, Islandii, Nigerii, Kenii, Kongo, Egipcie, Japonii, Australii, Niemczech, Anglii, Danii, Grecji, Turcji, Słowacji, Francji, Holandii, Pakistanie, na Hawajach, Haiti, krajach Ameryki Południowej i Południowej Afryki (Al-Sheikh i Abdelzaher 2010), Chinach (Tojo i in. 2005), Włoszech (Garibaldi i in. 2010), Omanie (Al-Sadi i in. 2012).
G. ultimum może silnie porażać większość roślin, z których się go izoluje i być głównym sprawcą zgorzeli siewek i zgnilizny korzeni na tych roślinach. Występuje na różnorodnych gospodarzach takich jak: babka, batat, bawełna, begonia, brzoskwinia, burak cukrowy, chryzantema, cytryna, dalia, dynia, fasola, groch, gwajula, hiacynt, jabłoń, kalia, katleja (z rodziny storczykowatych), kawa, krokus, melon, poinsecja, rabarbar, soja, sosna, tulipan, trzcina cukrowa, wyżlin większy (lwia paszcza), zimowit, różne gatunki traw i siewki wielu gatunków drzew (Van der Plaats-Niterink 1981). W ostatnich latach pojawiły się doniesienia o pojawieniu się patogena na kolejnych roślinach, np. na kapuście pekińskiej w Japonii (Kikumoto 1987) i Egipcie (El-Mohamedy i El-Mougy 2008), brokule (Kubota i in. 1996) i okrze – piżmianie jadalnym (Kida i in. 2006) w Japonii, kolendrze we Włoszech (Garibaldi i in. 2010), palmie daktylowej w Omanie (Al-Sadi i in. 2012), Acanthosicyos horridus (z rodziny dyniowatych) w Afryce (Rennberger i in. 2017). Może powodować poważne uszkodzenia traw, zwłaszcza na trawnikach sportowych (pola golfowe), gdzie w wyniku bardzo częstego koszenia system korzeniowy roślin ulega skróceniu (Allen i in. 2004).
G. ultimum można spotkać także w stawach i na rozkładających się roślinach. Do jego dużego rozprzestrzeniania się i utrzymywania w środowisku przyczynia się zdolność do saprotroficznego wzrostu w glebie i pozostałościach roślinnych. Ta cecha jest również wykazywana przez większość gatunków rodzaju Pythium s. lato (Van der Plaats-Niterink 1981).
Symptomy
W wyniku porażenia przez Globisporangium ultimum dochodzi do więdnięcia, redukcji plonu i ostatecznie śmierci rośliny. Typowe objawy infekcji to zahamowanie wzrostu roślin, brązowe zabarwienie koniuszków korzeni i więdnięcie rośliny w cieplejszych porach dnia (w ciągu nocy odżywają). Porażone rośliny żółkną i umierają. Symptomy mogą być mylące – interpretowane są czasem jako brak składników odżywczych.
Patogen jest sprawcą m.in. wodnej przyrannej zgnilizny bulw ziemniaka. Porażona bulwa jest wilgotna i odbarwia się na szaro, aż do koloru brązowego z ciemnym marginesem. Po przekrojeniu czuć zapach alkoholu, a w przypadku dużego porażenia zapach ryby. Bulwy mogą całkowicie się rozmiękczać, tworząc ciekły twór otoczony workiem ze skórki. Czasami wewnętrzna zgnilizna nie rozprzestrzenia się na zewnątrz poza pierścień naczyniowy. Plecha patogena nie jest widoczna gołym okiem na bulwach. Bardzo często zdarzają się infekcje wtórne, które mogą utrudniać diagnozę (Wale i in. 2008).
Uważa się, że na buraku cukrowym G. ultimum związany jest z temperaturą poniżej 20ºC. Powoduje zgnilizny siewek oraz zgorzel przedwschodową. W przypadku zgorzeli powschodowej objawy są identyczne jak w przypadku zaatakowania przez Rhizoctonia solani Kühn i obejmują więdnięcie, wyleganie oraz ostatecznie śmierć siewek (Leach 1986, Harveson 2006).
Wiele patogenów, w tym G. ultimum, odpowiada za zgnilizny korzeni siewek większości drzew iglastych i liściastych. Objawy chorobowe obejmują chlorozy liści i igieł, skarłowacenie i śmierć roślin. Czasami przed całkowitym zamarciem w miejscu nowych przyrostów następuje więdnięcie, tworząc twór przypominający kij pasterski. Pod glebą korzenie są słabiej rozwinięte, z kilkoma bocznymi i zasilającymi korzeniami. Często uszkodzenia dotyczą tylko drobnych cienkich korzeni, chociaż zdarzają się także nekrozy rozszerzające się na starsze tkanki. Zamierające siewki najłatwiej znaleźć w miejscach niżej położonych, tam gdzie gromadzi się woda. Ze względu na osłabiony system korzeniowy rośliny łatwo wyjąć z gleby, przy czym często ześlizguje się warstwa korowa, pozostawiając biały walec osiowy (Weiland 2012).
Na siewkach drzew w szkółkach leśnych całego świata patogen może oprócz zgnilizny korzeni powodować zgorzel siewek. Sprawcami tej choroby może być wprawdzie wiele gatunków różnych rodzajów, ale objawy są mało zróżnicowane (Dick i Vanner 1986). Wyróżnia się zgorzel przedwschodową i powschodową (choroba występuje najdalej do około szóstego tygodnia po wzejściu roślin; Mańka M. 1993, Mańka K. 1998). Do najbardziej charakterystycznych objawów zalicza się zgniliznę kiełków i korzeni, przewężenie i zbrunatnienie szyi korzeniowej oraz na końcu przewracanie się siewek (Mańka K. 1998; Fig. 13 i 14)
Na trawach gatunki rodzaju Pythium s. lato, w tym G. ultimum, powoduje zgorzel siewek. Najczęściej choroba atakuje siewki na nowo zakładanych trawnikach, ale może dotyczyć także roślin starszych w czasie lata i zimy (pod śniegiem). Największe szkody można zauważyć na trawnikach i polach golfowych , gdzie do podlewania używa się wody ze zbiorników wodnych, np. stawów. Na roślinach pojawiają się nagle ciemnozielone do purpurowych plamy o śr. 2-5 cm i mają zdolność szybkiego powiększania się. Łączą się na murawie w okrągłe lub nieregularne płaty o śr. 1-20 cm. Czasem na obrzeżach plam da się zauważyć białą plechę. Z tego względu choroba zwana jest "cottony blight". Objawy widoczne są najlepiej podczas ciepłej i wilgotnej pogody, kiedy darń pozostaje mokra ponad 12 h. Choroba przebiega szczególnie ciężko, kiedy temperatury w ciągu dnia przekraczają 28°C, a w nocy nie spadają poniżej 20°C. Oprócz liści objawy porażenia można zaobserwować na koronie, stolonie i korzeniach (Allen i in. 2004).
Patogen razem z innymi gatunkami rodzaju Pythium s. lato powoduje zgniliznę korzeni zbóż, w tym pszenicy. Atakowany jest system korzeniowy siewek i młodych roślin. Na korzeniach pojawiają się jasnobrązowe plamy, u podstawy łodyg widoczne są ciemnobrązowe plamy otoczone hialinową plechą (Cook i in. 1987).
Na roślinach dyniowatych (Cucurbitaceae Juss.) objawy mogą dotyczyć zarówno części nadziemnych, jak i podziemnych. Zgorzel siewek i zgniliznę korzeni powoduje szereg gatunków rodzaju Pythium s. lato (jednym z najczęściej występujących jest G. ultimum) oraz Phytophthora. Choroby te występują na arbuzie, dyni, kabaczku, melonie i ogórku. Symptomy na korzeniach są typowe dla Pythiaceae. Zgorzel poprzedzona jest chlorozą liści. Na dojrzałych roślinach pojawia się zgnilizna korzeni i korony. Początkowo ubożeje system korzeniowy, a potem na korzeniach bocznych pojawia się od jednej do kilku brązowych zmian chorobowych o dł. 0,3-2,0 cm. Zmiany rozszerzają się na korzeń główny, a liście korony często żółkną. Nekroza stopniowo postępuje ku górnym częściom rośliny. Zaburzone jest pobieranie składników odżywczych z gleby. Czasami jednak obserwowane są całkiem inne objawy. Zdrowo wyglądające rośliny więdną (kładą się) podczas gorących dni, ale niektóre z nich podnoszą się w nocy (Fig. 15-17). Zjawisko powtarza się następnego dnia, a rośliny zamierają w ciągu 2-4 dni. Na dyniowatych gatunki rodzaju Pythium s. lato mogą powodować także chorobę zwaną „Pythium cottony leak”, która może wystąpić na różnych częściach roślin, w różnych stadiach ich rozwoju. Choroba ta razem ze zgnilizną owoców jest powszechna. Najbardziej podatny jest ogórek. Patogen tworzy brązowe rozmięknięte zmiany chorobowe, które błyskawicznie zmieniają się w wodniste, miękkie i zgniłe obszary. Zgniłe miejsca zaczynają pokrywać się plechą, zwłaszcza w wilgotnych warunkach (Fig. 18 i 19), 16). U wielu dyniowatych choroba zazwyczaj rozpoczyna się od bezpośredniego kontaktu owocu z glebą. Na ogórku wystąpienie mokrej miękkiej zgnilizny poprzedzone jest często pojawieniem się brązowych do ciemnozielonych pęcherzyków z płynem (Zitter i in. 2010).
G. ultimum występuje często także na roślinach doniczkowych, m.in. na anturium i falenopsis. Infekcja zaczyna się od korzeni – początkowo brązowieją koniuszki, a potem reszta korzenia. Charakterystycznym objawem jest gnicie warstwy korowej (kora pierwotna między walcem osiowym a egzodermą, zewnętrzną warstwą kory pierwotnej). Egzoderma zaczyna obwisać jak worek wokół walca osiowego. Kiedy porażonych zostaje kilka korzeni, roślina zaczyna słabiej rosnąć. Ze względu na niedostateczne dostarczanie substancji odżywczych poprzez korzenie, liście przybierają kolor żółty. Dodatkowo osłabiona roślina staje się bardziej podatna na Fusarium spp., które po wniknięciu do rośliny może zdominować G. ultimum. Roślina ginie wtedy przez Fusarium spp., ale pierwotną przyczyną jest Globisporangium (Anthura 2018).
Zakażenie G. ultimum powiązane jest z występowaniem patogena w glebie i piasku. Ze względu na przestawienie się części hodowców na podłoża bezglebowe, zmniejsza się znaczenie tego patogena w uprawach doniczkowych (Moorman 2014).
Morfologia
Kolonie na pożywce CMA (corn meal agar) są włochate (Fig. 3 i 4), natomiast na PCA (potato carrot agar) tworzą promienisty wzór (Fig. 5 i 6). Temperatura minimalna do wzrostu to 5ºC, a maksymalna to 35ºC (optymalna 25-30ºC). Dla Pythium ultimum var. sporangiiferum podawaną temperaturą maksymalną jest 37-40ºC. Na PCA tempo wzrostu to ok. 30 mm/dzień w temp. 25ºC (Van der Plaats-Niterink 1981). Na pożywce PDA kultury są białe i puszyste, watowate; rewers biały. Plecha rośnie szybko i po 5 dniach inkubacji w temp. 24ºC zarasta najczęściej całą płytkę Petriego (Fot. 1, 2, 7, 8).
U G. ultimum może mieć miejsce zarówno rozmnażanie wegetatywne, jak i generatywne. Bezpłciowe odbywa się poprzez strzępki plechy lub nabrzmienia strzępek (hyphal swellings). Szerokość strzępek dochodzi do 11 µm. Sporangia zazwyczaj nie tworzą się, natomiast zoospory wytwarzane są sporadycznie poprzez krótkie „rurki” w temperaturze 5ºC. Nabrzmienia strzępek przybierają kulisty kształt o śr. 20-25(-29) µm; występują interkalarnie, czasem terminalnie (Van der Plaats-Niterink 1981).
G. ultimum należy do organizmów homotalicznych (samozapładniających). Rozmnażanie płciowe jest możliwe dzięki oogoniom i anteridiom (Fig. 9-12). Kuliste, o gładkich ścianach oogonia występują zazwyczaj terminalnie (rzadko interkalarnie), a ich śr. wynosi (14-)20-24(-25) µm. Na jedno oogonium przypada od 1 do 3 anteridiów. Oospory są kuliste, pojedyncze, aplerotyczne (występuje wolna przestrzeń między ścianą oogonium i ścianą oospory), o śr. (12-)17-20(-21) µm; ściana gruba, zazwyczaj o grubości 2 µm lub więcej (Van der Plaats-Niterink 1981). Żeby doszło do kiełkowania strzępek, po zapłodnieniu oogonium musi dojść do dojrzewania oospory. Następnie dodatkowo wymagana jest zazwyczaj faza spoczynku. Podczas kiełkowania oospora przekształca się w cienkościenną strukturę produkującą strzępkę kiełkową lub działa jak sporangium produkujące zoospory (Lumsden i Ayers 1975). Oospory uważa się powszechnie za pozwalające na przezimowanie odporne struktury, które umożliwiają przetrwanie przez długi czas (nawet lata) w niekorzystnych warunkach (Van der Plaats-Niterink 1981). Cecha ta odróżnia oospory od krótkotrwałych sporangiów i zoospor. Rozprzestrzenianie się w glebie zależy od wielu czynników, które mają wpływ na zdolne do zimowania struktury patogena (Ayers i Lumsden 1975). Takie czynniki jak temperatura poniżej 20ºC, wysoka wilgotność oraz dostępność cukrów i aminokwasów przyspieszają wzrostu strzępek oraz wzmagają kiełkowanie G. ultimum w glebie (Munnecke i in. 1971). Nabrzmienia strzępek patogena mogą przetrwać w wysuszonej lub wilgotnej glebie przez 11 miesięcy (Stanghellini i Hancock 1971). Po 2 latach przechowywania zakażonej gleby w temperaturze -18ºC, była ona nadal żródłem infekcji dla siewek astra i groszku (Munnecke i Moore 1969).
Do infekcji nasion i korzeni może dojść zarówno przez strzępki, jak i struktury rozmnażania płciowego.

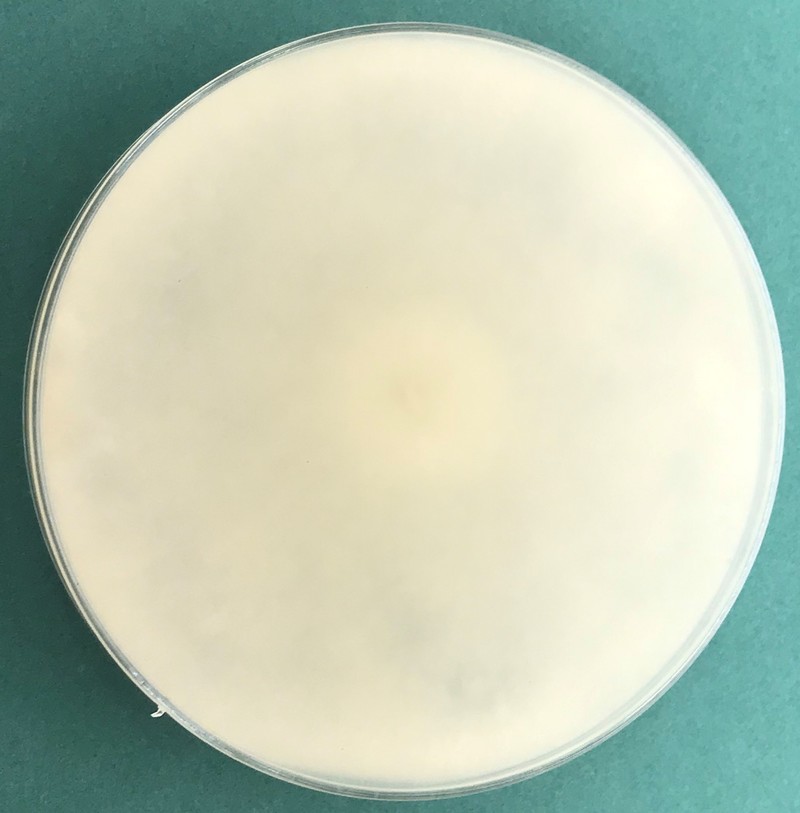
Fig. 1. 5-dniowa kultura Globisporangium ultimum na pożywce PDA
Fig. 2. Rewers 5-dniowej kultury G. ultimum na pożywce PDA

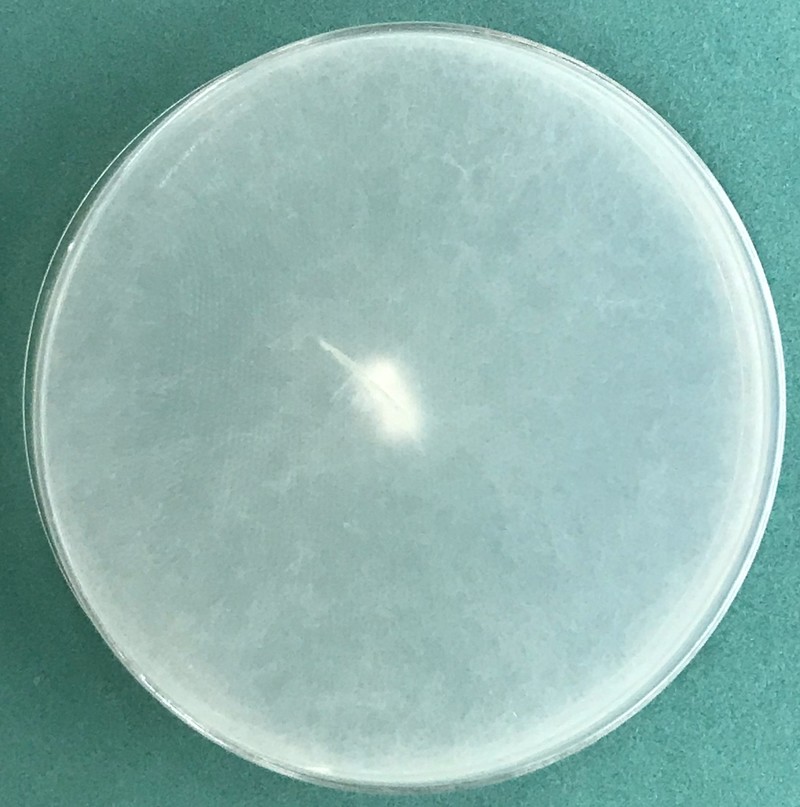
Fig. 3. 5-dniowa kultura Globisporangium ultimum na pożywce CMA
Fig. 4. Rewers 5-dniowej kultury G. ultimum na pożywce CMA


Fig. 5. 5-dniowa kultura Globisporangium ultimum na pożywce PCA
Fig. 6. Rewers 5-dniowej kultury G. ultimum na pożywce PCA

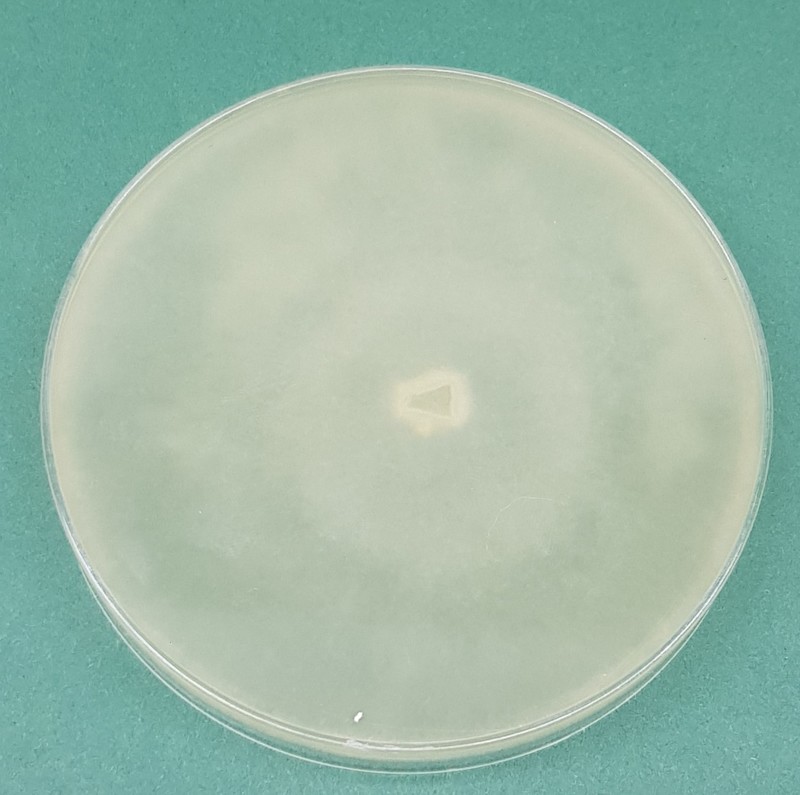
Fig. 7. 10-dniowa kultura Globisporangium ultimum na pożywce PDA
Fig. 8. Rewers 10-dniowej kultury G. ultimum na pożywce PDA
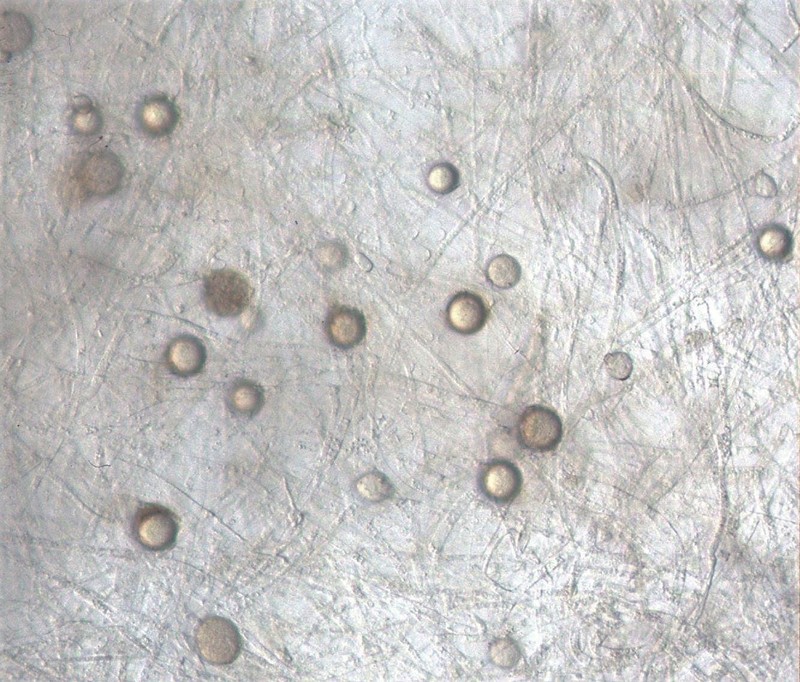
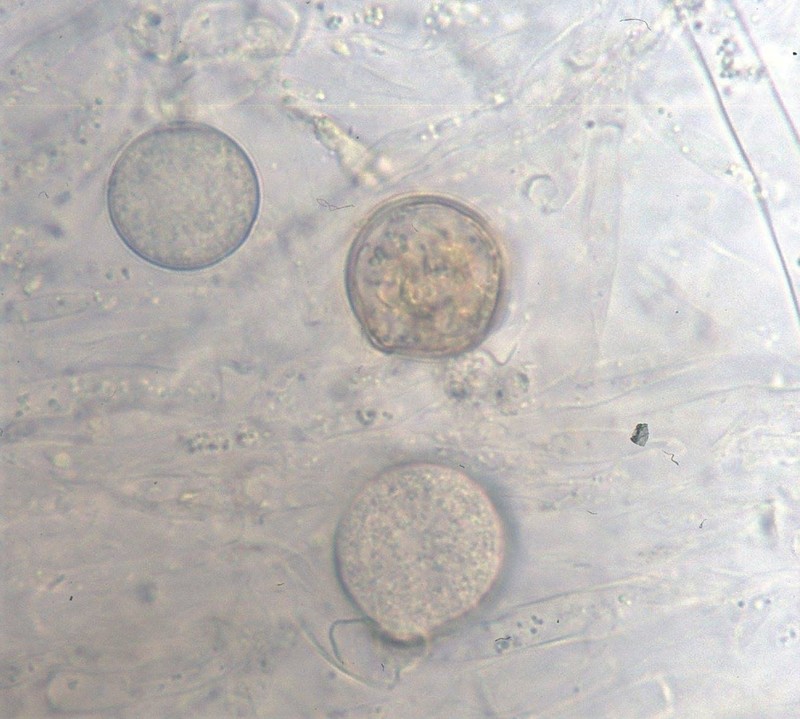
Fig. 9. Obraz mikroskopowy G. ultimum
Fig. 10. Obraz mikroskopowy G. ultimum
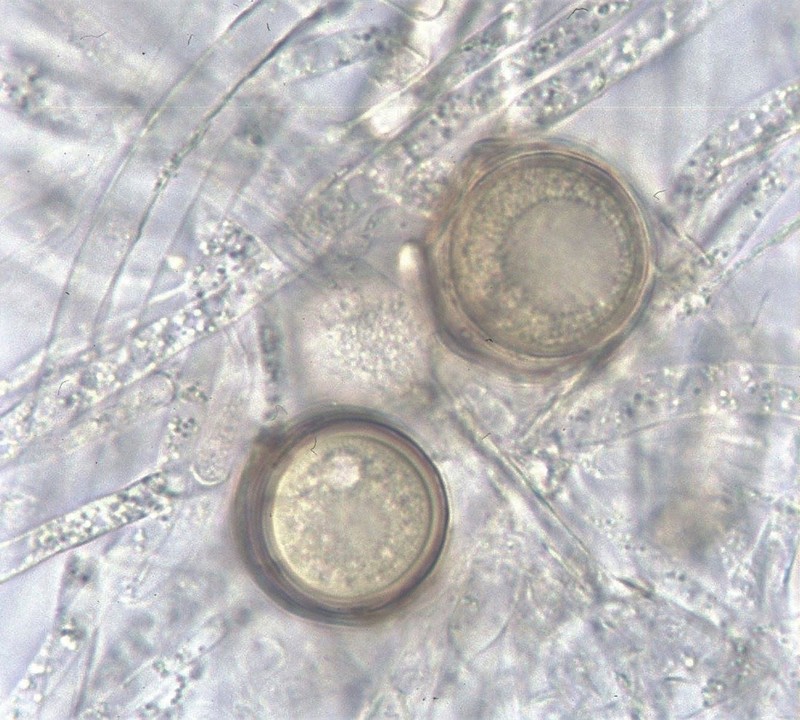
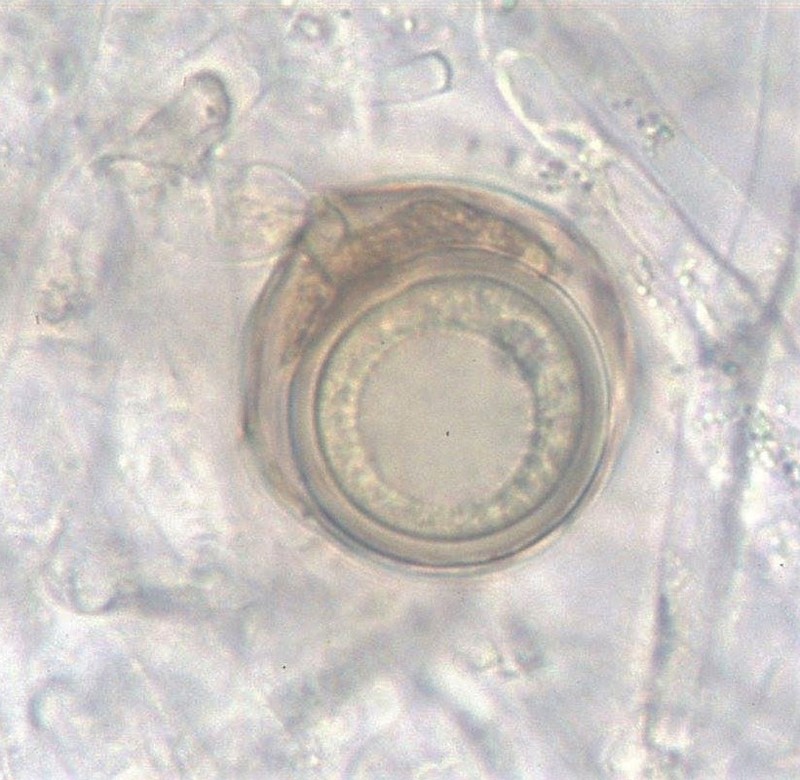
Fig. 11. Dojrzałe oogonia i anteridia G. ultimum
Fig. 12. Dojrzałe oogonium i anteridium G. ultimum


Fig. 13. Objawy zgorzeli siewek sosny
Fot. 14. Objawy zgorzeli powschodowej siewek sosny


Fig. 15. Więdnięcie ogórka spowodowane działaniem G. ultimum
Fig. 16. Zamieranie roślin ogórka spowodowane przez G. ultimum (Z. Janik)


Fig. 17. Objawy nekrozy i zamierania roślin ogórka – skutek działania G. ultimum (Z. Janik)
Fig. 18. Ogórki pokryte plechą G. ultimum

Fig. 19. Zgnilizna owoców ogórka powodowana przez G. ultimum