Rhizoctonia solani
RHIZOCTONIA SOLANI
J.G. Kühn
Systematyka
Stadium teleomorfy
Gromada: Basidiomycota
Klasa: Agaricomycetes
Rząd: Cantharellales
Rodzina: Ceratobasidiaceae
Rodzaj: Thanatephorus
Gatunek: Thanatephorus cucumeris (A.B. Frank) Donk
Stadium anamorfy
Grzyby mitosporowe (anamorficzne) – Fungi Imperfecti
Grupa morfologiczna: Hyphomycetes
Rodzaj: Rhizoctonia
Gatunek: Rhizoctonia solani J.G. Kühn
Synonimy:
Moniliopsis aderholdii Ruhland
Moniliopsis solani (J.G. Kühn) R.T. Moore
Rhizoctonia grisea (J.A. Stev.) Matz
Rhizoctonia napaeae Westend. & Wallays
Gatunek Rhizoctonia solani Kühn opisał pierwszy raz Julius Kühn na ziemniaku w 1858 roku. Basidiospory i basidia wytwarzane przez teleomorfy tego grzyba zostały pierwszy raz zaobserwowane i szczegółowo opisane przez Prillieux’a i Delacroix’a w 1891 roku (Parmeter 1970).
Choroby roślin powodowane przez R. solani mają znaczenie zarówno w rolnictwie, ogrodnictwie, jak i w leśnictwie na całym świecie. Grzyb został znaleziony na wielu roślinach, uprawianych zarówno pod okrywami jak i w polu, do których należą zboża, trawy, warzywa, kwiaty, rośliny ozdobne, drzewa leśne i owocowe. Ponadto może bytować w glebie jako saprotrof lub pozostawać w związkach mikoryzowych z orchideami (Parmeter 1970, Ogoshi 1987, Adams 1988). Wielu taksonomów już dawno zgodziło się, że nie jest to jednolity gatunek, ale raczej kompleks gatunków wykazujących zróżnicowanie w zakresie morfologii, patogeniczności i fizjologii (Ogoshi 1987).
Symptomy
Rhizoctonia solani jest grzybem glebowym, stąd uszkadza przede wszystkim podziemne części roślin (nasiona, kiełki, korzenie, bulwy; Fig. 5-11), ale może porażać także nadziemne części (łodygi, liście, strąki, owoce). Grzyb poprzez grzybnię i/lub skleroty może przedostawać się na owoce i liście stykające się z glebą bądź też na dalsze części roślin za pomocą rozbryzgujęcych się kropel wody. Najbardziej narażone na infekcje są młode, wolno rosnące rośliny. Rośliny szybko rosnące zwykle „umykają” patogenowi. Grzyb powoduje szereg chorób, takich jak zgnilizna korzeni (Fig. 7), zgorzel podstawy źdźbeł zbóż i pędów, zamieranie kiełków i łodyg, oraz zgorzel siewek, zarówno roślin zielnych, jak i drzew i krzewów (Sneh i in. 1991). Zgorzel siewek, zwłaszcza motylkowatych i krzyżowych, należy do najpowszechniejszych chorób siewek, powodowanych przez R. solani, prowadzących do zamierania siewek. Wyróżnia się zgorzel przedwschodową i powschodową – obserwuje się zgniliznę kiełków i korzeni, przewężenie i zbrunatnienie szyjki korzeniowej oraz na końcu przewracanie się siewek (Fig. 5-6 i 8). Siewki, którym uda się przetrwać posiadają czerwono-brązowe patologiczne zmiany na korzeniach i łodygach. Patogen zdolny jest do wyrastania w postaci grzybni z porażonej siewki w kierunku sąsiednich zdrowych, powodując charakterystyczne placowe zamieranie siewek (Parmeter 1970, Borecki 1996).
W Polsce za najbardziej niebezpieczną formę choroby uważa się rizoktoniozę ziemniaka. Objawia się ona zgnilizną kiełków, próchnieniem podstawy łodygi oraz tzw. ospowatością bulw (Fig. 10). Każda z tych postaci może stanowić kolejne etapy rozwoju choroby, badź też występować niezależnie. Najbardziej niebezpieczne jest porażonie kiełków, a na ich powierzchni pojawiają się brunatne powiększające się plamy i całe kiełki gniją. Roślina wytwarza słabsze i cieńsze tzw. kiełki wtórne (także mogą ulec porażeniu), co poprzez opóźnienie i osłabienie wschodu roślin obniża plony ziemniaka (Borecki 1996).
W przypadku buraka cukrowego Rhozoctonia solani prowadzi do powstania tzw. brunatnej zgnilizny pojawiającej się na plantacjach placowo już w czerwcu i lipcu. Początkowo obserwuje się więdnięcie roślin i żółknięcie liści, które później całkowicie obumierają. Na powierzchni korzenia pojawiają się brunatne plamy sięgające w głąb tkanki. W początkowym okresie wzrostu buraka grzyb atakuje kiełki i siewki (zgorzel siewek), a w późniejszym okresie wegetacji powierzchnię korzenia (brunatna zgnilizna). Grzyb stopniowo przenika do środka korzenia powodując jego gnicie, aż do całkowitego zniszczenia rośliny. W warunkach sprzyjających rozwojowi choroby, przy odpowiednio wczesnym porażeniu, rośliny zamierają. Brunatna zgnilizna może powodować zamieranie pojedynczych roślin na plantacjach lub kilku (kilkadziesiąt) roślin w niewielkich ogniskach (Borodynko i in. 2011).
Rośliny pomidora, podobnie jak buraka, zamierają po zaatakowaniu przez Rhozoctonia solani tylko przy wczesnej infekcji. Patogen poraża je głównie wiosną zaraz po posadzeniu, powodując gnicie korzeni i szyjki korzeniowej. Na szyjce korzeniowej zainfekowanych roślin (tuż pod powierzchnią gleby) tworzą się lekko wklęsłe, suche, brunatne plamy okalające podstawę łodygi. Ich brzegi są wyraźnie odgraniczone od zdrowej tkanki. Nad strefą porażenia na łodydze tworzą się liczne korzenie przybyszowe. Na starszych roślinach dolne liście żółkną i więdną, lecz rzadko zamierają. Przy dużej wilgotności porażone miejsca zasiedlane są dodatkowo przez bakterie lub Botrytis cinerea Pers., sprawcę szarej pleśni, co prowadzi do mokrej zgnilizny u podstawy łodygi (Ślusarski 2000).
Chociaż większość chorób powodowanych przez R. solani jest inicjowanych przez grzybnię i/lub przetrwalniki, kilka ważnych chorób fasoli, buraków cukrowych, tytoniu wynika z infekcji basidiosporami. Mogą one służyć również jako źródło szybkiego i na duże odległości rozproszenia się grzyba. Zarodniki podstawkowe kiełkują produkując grzybnię, która infekuje liście w okresach wysokiej wilgotności względnej i przy dłuższym deszczu. W takich warunkach basidiospory można obserwować na podstawie łodygi przy powierzchni ziemi lub stykającej się z glebą dolnej stronie liści (Parmeter 1970, Ogoshi 1975).
Morfologia
W cyklu życiowym Rhizoctonia solani występuje najczęściej w postaci grzybni wegetatywnej. Młoda grzybnia jest bezbarwna, natomiast z wiekiem (w miarę grubienia ścian) nabiera koloru brązowego - od bardzo jasnego do ciemnego brązu (Fig. 1 i 2). Wstępnie izolaty tego gatunku opisał Duggar (1915), ale dopiero w 1970 roku Parmeter i Whitney uzupełnili ten opis podając informacje o liczbie jąder w komórce, grzybni i sklerocjach. Rhizoctonia solani wytwarza płonną grzybnię, która składa się z wydłużonych komórek i rozgałęzień nachylonych mniej więcej pod kątem prostym względem głównej grzybni. Każda komórka przy końcu ma przewężenie i zaopatrzona jest w poprzeczną przegrodę umiejscowioną w pobliżu połączenia z komórką sąsiednią (Fig. 3 i 4). Cechy morfologiczne rozgałęzień grzybni są zasadniczymi własnościami identyfikującymi Rhizoctonia spp. Strzępki są wielojądrowe (posiadają trzy lub więcej jąder w komórce) i stosunkowo grube (średnica 6/8–12/15 μm).
R. solani nie wytwarza zarodników bezpłciowych zwanych konidiami, a w niekorzystnych warunkach pojawiają się zwarte skupienia grubościennych strzępek przetrwalnikowych zwanych są sklerocjami. Sklerocja mają średnicę 1-3 mm, nieregularny kształt, barwę od beżowej poprzez brązową do czarnej. Dzięki nim patogen może przetrwać przez wiele lat w glebie lub na powierzchni tkanki roślinnej. Optymalną temperaturą dla infekcji jest 16–25°C, natomiast optymalnym odczynem – pH 4,5–6,5, chociaż wiele izolatów może rosnąć także przy pH 3–8 (Domsch i in. 1980).
W warunkach wysokiej wilgotności na zainfekowanych roślinach pojawiają się owocniki stadium mejomorficznego, Thanatephorus cucumeris, z zarodnikami podstawkowymi i są one rozpostarte, białe lub szarobiałe. Każda podstawka (basidium) produkuje 4 zarodniki płciowe. Przy dużej wilgotności basidiospory posiadające po jednym jądrze rozpraszają się i kiełkują. Chociaż występowanie Thanatephorus cucumeris jest stosunkowo częste, strzępki wyrastające z zarodników podstawkowych zwykle nie zakażają roślin (Parmeter i Whitney 1970, Ogoshi 1975).
Badania nad dokładną morfologiczną charakterystyką są niepełne ze względu na brak zarodnikowania. Jedyna możliwa rekombinacja genetyczna R. solani jest możliwa wyłącznie przez anastomozy (fuzje) tworzące się między strzępkami izolatów bardzo bliskich genetycznie. Na tej podstawie dokonano podziału R. solani na tzw. grupy anastomozowe (anastomosis groups – AGs), inaczej kojarzeniowe. W obrębie każdej AG znajdują się odrębne jednostki, które często różnią się między sobą preferencjami względem rośliny-gospodarza i stopniem patogeniczności. Każda grupa anastomozowa może być traktowana jako odrębna genetycznie populacja (Ogoshi 1987, Kronland i Stanghellini 1988). Do chwili obecnej wyróżniono czternaście grup anastomozowych, obejmujących grupy od AG1 do AG13 oraz AGB1 (Ogoshi 1987, Carling i in 1987, 2002, MacNish i in. 1995, Carling 1996). Siedem z tych 14-tu grup (AG1, AG2, AG3, AG4, AG6, AG8 i AG9) zostało ponadto podzielonych na podgrupy, które odzwierciedlają obserwowane pomiędzy izolatami różnice w zakresie częstości występowania anastomoz, budowy kwasów tłuszczowych i izoenzymów, patogeniczności, wymagań względem tiaminy i wyglądu kultur pomiędzy izolatami w grupie (Ogoshi 1987). Niektóre grupy anastomozowe charakteryzują się występowaniem tylko w określonych rejonach geograficznych, a inne są wyspecjalizowane w porażaniu pewnych gatunków roślin. Izolaty z czterech grup, które pierwsze zostały opisane (AG1, AG2, AG3 i AG4), uznano za najważniejsze patogeny powodujące choroby roślin na całym świecie natomiast izolaty z AGs opisanych później – za mniej groźne patogeny, o bardziej ograniczonym zasięgu geograficznym (Parmeter 1970, Ogoshi 1987, Sneh i in. 1991).
Większość izolatów R. solani pochodzących z ziemniaka, należy do AG3 (Rhizoctonia solani var. typica Schultz). Ze względu na specjalizację w stosunku do rośliny-gospodarza, grupa ta została określona jako „typ ziemniaczany” (ang. potato type; Watanabe i Matsuda 1966). Izolaty tej grupy rosną wolno (ok. 12 mm na dzień w temperaturze 25°C) i oprócz ziemniaka infekują także pomidor i tytoń, a także siewki buraka cukrowego i sałatę (Sneh i in. 1991).


Fig. 1. Dziesięciodniowa kultura R. solani na pożywce PDA
Fig. 2. Spód dziesięciodniowej kultury R. solani na PDA
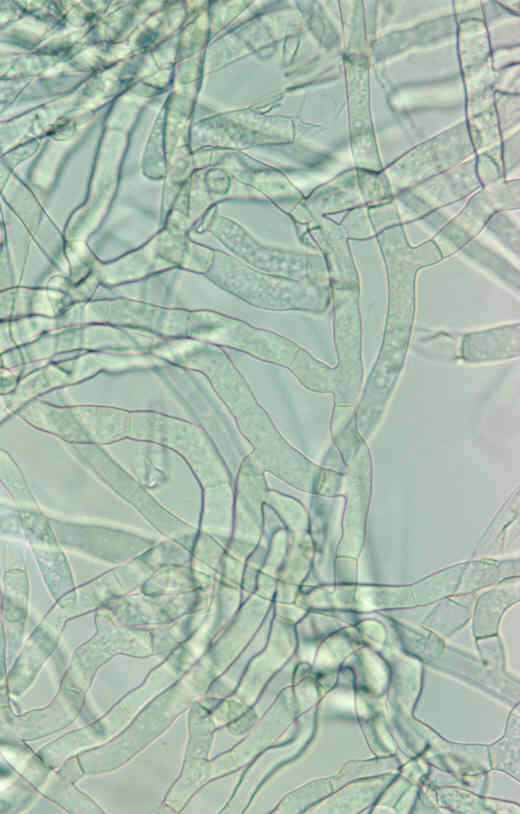
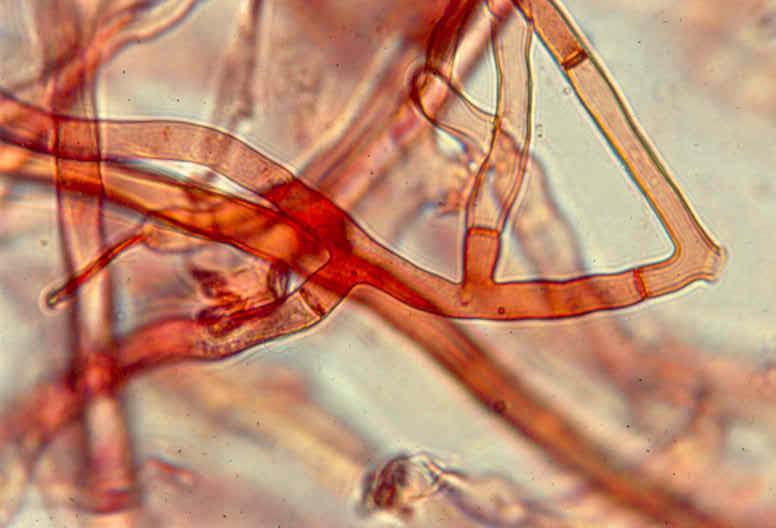
Fig. 3. Grzybnia R. solani
Fig. 4. Grzybnia R. solani wybarwiona roztworem safraniny


Fig. 5. Zgorzel siewek łubinu spowodowana przez R. solani
Fig. 6. Siewki łubinu porażone przez R. solani


Fig. 7. Objawy zgnilizny korzeni łubinu spowodowanej przez R. solani
Fig. 8. Siewka przenżyta porażona przez R. solani (G. Lemańczyk)


Fig. 9. Sklerocja R. solani na porażonym korzeniu marchwi (M. Mańka)
Fig. 10. Ospowatość bulw ziemniaka porażonego przez R. solani
Zróżnicowanie genetyczne populacji wirusa czarnej pierścieniowej plamistości pomidora (Tomato black ring virus, TBRV)
Populacja wirusa czarnej pierścieniowej plamistości pomidora w kraju i na świecie
czytaj więcejRekombinanty w polskiej populacji wirusa mozaiki ogórka (Cucumber mosaic virus, CMV)
Rekombinanty w polskiej populacji wirusa mozaiki ogórka (Cucumber mosaic virus, CMV)
czytaj więcejWirus mozaiki pepino - zmienność i diagnostyka.
Wirus mozaiki pepino (Pepino mosaic virus, PepMV) jest obecnie jednym z najgroźniejszych patogenów pomidora szklarniowego w wielu krajach, w tym w Polsce.
czytaj więcejTospowirusy - zagrożenie dla warzyw i roślin ozdobnych.
Wirus brązowej plamistości pomidora (Tomato spotted wilt virus, TSWV), należący do rodzaju Tospovirus jest niebezpiecznym patogenem porażającym ponad 1090 gatunków roślin.
czytaj więcejWirus Y ziemniaka na pomidorze
Wirus Y ziemniaka (Potato virus Y, PVY) należący do rodziny Potyviridae jest groźnym patogenem, szczególnie dla upraw o dużym znaczeniu gospodarczym, jak ziemniak, tytoń, pomidor czy papryka.
czytaj więcej